







《《化学反应与能量》高中必修二化学总结复习PPT教学课件》是由用户上传到老师板报网,本为文库资料,大小为651 KB,总共有20页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 20页
- 651 KB
- VIP模板
- ppt
- 数字产品不支持退货
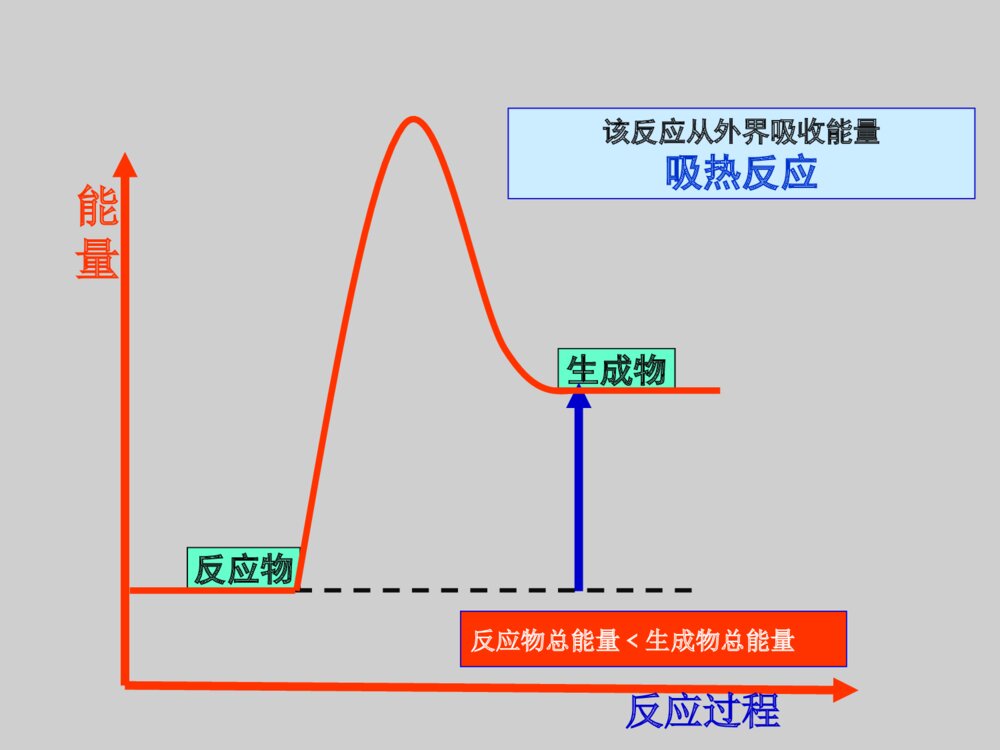
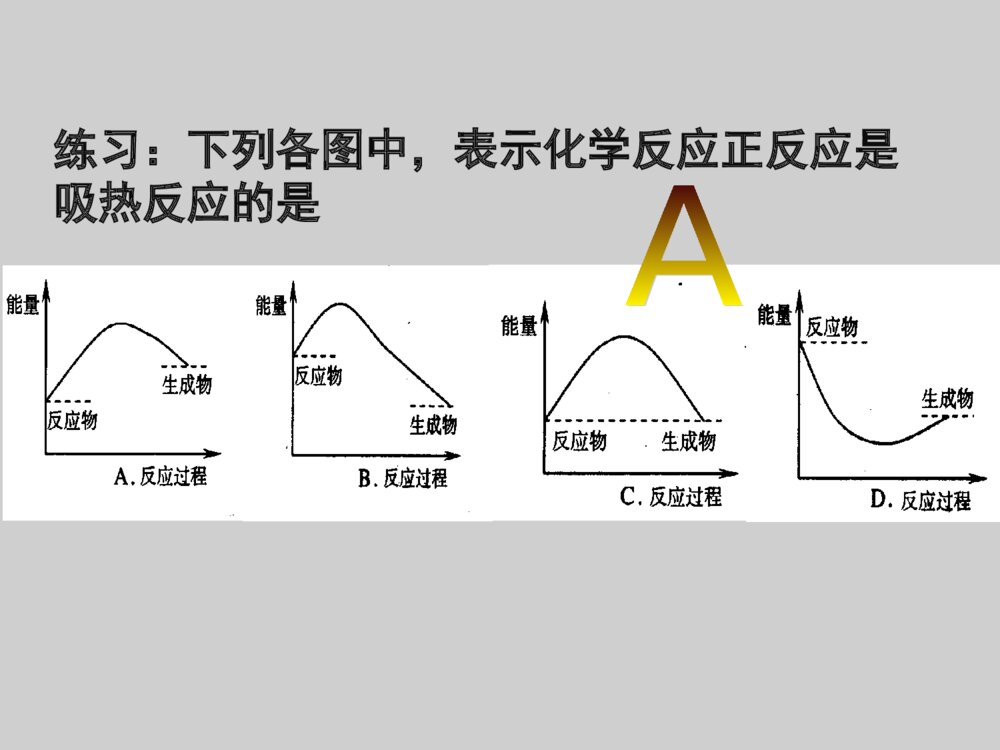
一.化学能与热能二.化学能与电能三.化学反应速率四.化学反应的限度复习课一、化学能与热能1、化学反应的实质:旧化学键断裂,新化学键形成的过程。2、任何化学反应都伴随着能量的变化!引起化学反应中的能量变化:(1)微观:化学键的断裂和形成是化学反应中能量变化的主要原因;化学键的断裂——吸收能量;化学键的形成——放出能量。反应物键能生成物键能化学反应=旧化学键断裂+新化学键形成(吸收总能量E1)(放出总能量E2)①当E1>E2,反应吸收能量②当E1<E2,反应放出能量(2)宏观:在化学反应中,反应物的总能量与生成物的总能量间的能量差。(即化学能)EAEB①反应物总能量>生成物总能量反应放出能量②反应物总能量<生成物总能量反应吸收能量反应过程反应物生成物能量该反应从外界吸收能量吸热反应反应物总能量﹤生成物总能量练习:下列各图中,表示化学反应正反应是吸热反应的是5.5.常见的放热反应:常见的放热反应:((11)所有的燃烧反应)所有的燃烧反应(剧烈的发光发热的化学反应)(剧烈的发光发热的化学反应)((22)酸碱中和反应)酸碱中和反应((33)大多数的化合反应)大多数的化合反应((44)金属与酸的反应)金属与酸的反应((55)放热过程:浓硫酸稀释、)放热过程:浓硫酸稀释、固体氢氧化钠溶解固体氢氧化钠溶解高温(C+CO2=2CO吸热反应)中和热:中和热:酸与碱发生中和反应生成酸与碱发生中和反应生成1mol1mol水水所释放的热量称为所释放的热量称为中和热中和热。。66..常见的吸热反应:常见的吸热反应:((11)铵态氮肥和碱的反应)铵态氮肥和碱的反应(晶体(晶体Ba(OH)Ba(OH)22•8H•8H22O+NHO+NH44ClCl的反应)的反应)((22)大多数的分解反应(特别持续加热的))大多数的分解反应(特别持续加热的)((33)以)以HH22、、COCO、、CC为还原剂的氧化还原为还原剂的氧化还原反应反应((除了它们参与的燃烧反应除了它们参与的燃烧反应))1、拆开1molH-H键、1molNN键分别需要吸收的能量为436KJ,946KJ,形成1molN-H键需放出能量391KJ,则1molN2生成NH3需热量KJ。(不考虑可逆反应)放出92定义:构成条件:判断:正负极工作原理:(总的氧化还原反应,电极反应)应用分析常见、简单电池工作原理。比较金属活动性强弱。加快化学反应速率判断溶液pH变化。三、原电池(从活泼性比较、电子得失、氧化还原反应、电子电流流向等多角度判断)设计简单电池。将化学能转化为电能的装置本质:自发的氧化还原反应发生两极一液一回路电极反应式:铜.锌.稀H2SO4组成的原电池负极(Zn):Zn-2e-=Zn2+(氧化反应)正极(Cu):2H++2e-=H2↑(还原反应)注:得失电子相等,总反应式:两式相加2H++Zn=H2↑+Zn2+氢氧燃料电池氢氧燃料电池ZnCuZnCuAABBCCDDEEFF1、下列哪些装置能构成原电池?GG水果C.D.G3、Cu、Fe作两极,稀硫酸作电解质溶液的原电池中:①Cu作____极,Fe②作____极电极反应式是:负极____________正极_____________总反应式是___________________________正负Fe-2e-=Fe2+2H++2e-=H2↑Fe+H2SO4=FeSO4+H2↑或Fe+2H+=Fe2++H2↑1、概念:浓度常用mol·L-1,时间常用s,min。3、单位:2、表达式:ν=ct三、化学反应速率用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示mol/(L·min)或mol/(L·s)注意:1、在同一反应体系中用不同的物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示反应速率。因此化学反应速率的表示必须说明用哪种物质来做标准。2、用同一反应体系中不同物质表示同一速率时,其数值比一定化学方程式中相应的化学计量数之比。3、化学反应速率均用值来表示.且表示的是速率而不是速率.同一个等于正平均瞬时比较反应的快慢,应取同一参照物④不用固体或纯液体表示化学反应速率4、影响化学反应速率的条件:影响化学反应速率的条件内因外因物质的性质(主要)温度、浓度、压强、催化剂等4、外界条件对化学反应速率的影响浓度:温度:催化剂:浓度大,反应速率快温度高,反应速率快催化剂一般加快反应速率固体的表面积:压强(气体):压强大,反应速率快表面积大,反应速率快5、化学反应限度的定义:反应平衡状态的特点:逆等动定变:可逆反应:v正=v逆:v正=v逆≠0:平衡时,各组分浓度保持恒定:条件改变,平衡改变其中“等”和“定”判断化学反应是否处于平衡状态的关键例:N2+3H22NH3高温、高压催化剂任何化学反应都有一定的限度,不同的化学反应限度不同。一定条件下的可逆反应,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变时,达到化学平衡状态.这就是这个反应所能达到的限度。交流·研讨化学平衡的标志:反应速率反应时间v正v逆ν正=ν逆1.ν正=ν逆2.反应混合物中各组分的含量保持不变练习:反应A+3B=2C+2D在四种不同条件下的反应速率为:(1)v(A)=0.3mol/L·s(2)v(B)=0.6mol/L·s(3)v(C)=0.2mol/L·s(4)v(D)=0.45mol/L·s则该反应速率的快慢顺序为—————————。(1)>(4)>(2)>(3)比较反应的快慢,应取同一参照物且单位相同例题.一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)==2Z(g)一定达到化学平衡状态的是()A.X、Y、Z的物质的量之比为1:2:2B.X、Y、Z的浓度不再发生变化C.容器中的压强不再发生变化D.单位时间内生成nmolX,同时生成2nmolYE.单位时间内生成nmolZ,同时生成2nmolYBC



















